
Elizabeth Rainbow
Proteínas
10/11/19
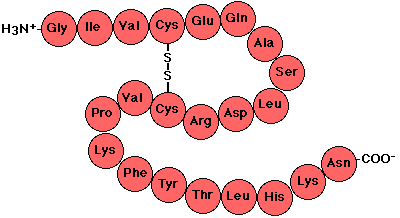
Las proteínas son moléculas formadas por conjuntos de aminoácidos, compuestos orgánicos sencillos de bajo peso molecular, unidos por enlaces peptídicos.
LOS AMINOÁCIDOS
Presentan los grupos indicados a continuación unidos mediante enlaces covalente al carbono alfa.
-
Solubles en agua
-
Sólidos
-
Cristalizables
-
Más o menos incoloros
-
Carácter anfótero (explicado en las actividades)
-
Elevado punto de fusión
-
Actividad óptica.
Existen 20 aminoácidos proteicos clasificados en:.
-
Hidrófóbos: alanina, valina, leucina, isoleucina…
-
Hidrofílícos: serina, treonina, glutamina, asparagina…
-
Ácidos: ácido aspártico y ácido glutámico.
-
Básicos: lisina, arginina, histidina.
AMINOÁCIDOS ESENCIALES
Aquellos que los animales no pueden sintetizar son:
-
Valina
-
Leucina
-
Isoleucina
-
Metionina
-
Fenilalanina
-
Triptófano
-
Treonina
-
Lisina
-
En los lactantes, Histidina.
ENLACE PEPTÍDICO
Según el número de aminoácidos que presente las cadenas pueden formar:
-
Dipéptidos:La unión de los aminoácidos.
-
Tripéptidos: La unión de tres aminoácido
-
Oligopéptido: La unión de menos de 10 aminoácidos
-
Polipéptido: la unión de +10 aminoácidos
PROTEÍNAS
ESTRUCTURA PRIMARIA
-
Formando collar de perlas.
-
Enlace peptídico.
ESTRUCTURA SECUNDARIA
-
SÍ giro
Existen tres tipos de estructura secundaria según:
-
Aminoácidos
-
Tensión
-
Temperatura
-
N° de puentes de hidrógeno
α-hélice
-
Collar de perlas enrola en espiral sobre si misma
-
Estable por enlaces de hidrógeno intracatenarios.
-
Rotación dextrógira.
conformación β/ lámina plegada
-
Enlaces de hidrógeno intercatenarios.
-
NO enlaces hidrógeno entre aa próximos
-
SÍ entre repliegues
-
Pueden unirse de forma:
-
Paralela N-C
-
Antiparalela N-C y C-N
-
hélice de colágeno
-
Prolina + hidroxiprolina
-
Enrolla de forma levógira
-
1 vuelta/3 aa
-
Ejemplo COLÁGENO
ESTRUCTURA TERCIARIA
-
Estructura secundaria en conformación globular
-
Estable gracias a:
-
Enlaces de hidrógeno
-
Atracciones electrostáticas
-
Atracciones hidrofóbicas
-
Puerzas de Van der Waals
-
Puentes disulfuro
-
-
Existen dos tipos
-
Proteínas Globulares:
-
Solubles
-
Función
-
Enzimática
-
Transportadora
-
Hormonal
-
Anticuerpos
-
-
-
Proteínas Filamentosas
-
Insolubles
-
Función estructural
-
-
ESTRUCTURA CUATERNARIA
-
2 o + cadenas polipeptídicas con estructura terciaria
-
PROTÓMERO
CLASIFICACIÓN
-
Holoproteínas
-
Proteínas fibrosas
-
Colágeno
-
Miosina
-
Queratina
-
Fibrina
-
Elastina
-
-
Proteínas globulares
-
Actina
-
Albúminas
-
Ovoalbúmina
-
Lactoalbúmina
-
Seroalbúmina
-
-
Globulinas
-
Lactoglobulina
-
Ovoglobulina
-
Seroglobulina
-
α-globulina
-
Inmunoglobulinas
-
-
Histonas
-
-
-
Heteroproteínas
-
Cromoproteínas
-
Porifirínicas
-
No porifirínicas
-
-
Nucleoproteínas
-
Glucoproteínas
-
Fosfoproteínas
-
Lipoproteínas
-
LDL
-
HDL
-
-
PROPIEDADES
-
Solubilidad
-
Desnaturalización
-
Especifidad
-
De función
-
De especie
-
-
Capacidad amortiguadora
FUNCIONES
-
Reserva
-
Función de transporte
-
Lipoproteínas
-
Citocromo
-
Hemoglobina
-
Mioglobina
-
-
Función contráctil
-
Actina y miosina
-
Flagelina
-
-
Función protectora o defensiva
-
Trombina y fibrinogeno
-
Inmunoglobulinas
-
-
Transducción de señales
-
Rodopsina
-
-
Función hormonal
-
Insulina
-
Glucagón
-
-
Función estructural
-
Histonas
-
Tubulina
-
Elastina
-
-
Función enzimática
-
Función homeostática
-
Función de reconocimiento de señales químicas
Para finalizar la explicación, agrego un resumen esquemático del temario.



--------------------🐟🍗🥚--------------------
ACTIVIDADES DE REPASO
ACTIVIDAD 1
a) En cuanto a la estructura de las proteínas, pueden existir con estructura primaria, estructura secundaria, que a su vez puede separarse en α-hélice, conformación o β lámina plegada, y hélice de colágeno, estructura terciaria, separada en proteínas globulares y proteínas fibrosas o filamentosas, y finalmente estructura cuaternaria.
b) En la estructura primaria intervienen enlaces peptídicos, en la estructura secundaria α-hélice, son enlaces de hidrógeno intracatenarios los que le dan estabilidad, en la lámina plegada β, son enlaces de hidrógeno intercatenarios, y en hélice de colágeno, son enlaces covalentes y enlaces de hidrógeno. En la estructura terciaria intervienen enlaces de hidrógeno entre grupos peptídicos, atracciones electrostáticas entre grupos con carga opuesta, atracciones hidrofóbicas, fuerzas de Van der Waals y finalmente puentes disulfuro entre grupos tiol. Finalmente, en la estructura cuaternaria, la estabilidad se consigue a partir de enlaces débiles no covalentes, o en ocasiones enlaces covalentes del tipo disulfuro.
c) Las α-queratinas son proteínas fibrosas, correspondientes con la estructura secundaria de α-hélice.
d) Solubilidad: los radicales polares de la superficie externa de las proteínas establecen enlaces de hidrógeno con las moléculas de agua. La proteína se rodea de agua, que impide su unión con otras proteínas, por lo tanto provoca su precipitación. En general, las proteínas fibrosas son insolubles en agua.
Capacidad Amortiguadora: Debido a su carácter anfótero, pueden actuar de base o ácido según la situación, cediendo o captando
protones del medio, por tanto, amortiguan las variaciones del pH del medio.
e)
Reserva: Actúan de reserva energética almacenando aminoácidos para después emplearlos como nutrientes o participando en la formación del embrión. Un ejemplo es la ovoalbúmina, que se encuentra en la clara de huevo.
Función de transporte: Las proteínas de unen a diversas sustancias y las transportan a través de un medio acuoso. Un ejemplo serían las lipoproteínas, que transportan los lípidos a través del plasma sanguíneo.
f) La desnaturalización se define como la rotura de enlaces que mantienen el estado más estable de la proteína, que tiene la menor cantidad de energía libre (estado nativo). Los enlaces peptídicos mantienen la estructura primaria en forma filamentosa.
Cuando una proteína se desnaturaliza, pierde las estructuras secundaria (a veces), terciaria (siempre) y cuaternaria (cuando la hay), y por lo tanto pierden su actividad biológica. Cuando esto pasa, adoptan una conformación filamentosa y precipitan, ya que los grupos hidrofóbicos antes aislados comienzan a establecer interacciones y se agrupan.
Los factores que provocan esta desnaturalización son el pH (OH- y H+ afectan la envoltura acuosa y la carga eléctrica. Eliminan interacciones electrostáticas, por lo tanto pierden su estructura terciaria, por tanto precipitan), la temperatura (elevar la tª produce agitación, debido a la cual se desordenan la envoltura acuosa y se desnaturalizan), la polaridad del disolvente (disminuye al añadir sustancias no polares, por lo que disminuye el grado de hidratación de los grupos iónicos superficiales, provocando la desorganización de la estructura terciaria por lo tanto precipita y se desnaturaliza) o sustancias desnaturalizantes como la urea (aumenta la fuerza inicia del medio, por lo que disminuye el grado de hidratación de los grupos ionicos. La urea compite con el agua y rompe los puentes de hidrógeno, por lo tanto las proteínas de agregan y precipitan).
Este proceso puede ser reversible, ya que las proteínas pueden llevar a replegarse nuevamente en su conformación nativa, recuperando así la actividad biológica perdida, gracias al mantenimiento de los enlaces peptídicos de la estructura primaria que no se han visto afectados por el proceso de desnaturalización. En el caso de que sea reversible, se le denomina renaturalización.
g) El hecho de que tenga carácter anfótero quiere decir que tiene la capacidad de actuar como ácido o como base, captando o cediendo protones, en función del medio en el que se encuentren. Gracias a esto pueden regular el pH del medio.
ACTIVIDADES PAU
ACTIVIDAD 1
a) Los monómeros unidos en la reacción son aminoácidos, que cuando se juntan de esta manera forman una macromolécula llamada péptido, en este caso un dipéptido ya que solamente aparecen unidas 2 aminoácidos.
b) El enlace formado en la reacción entre el grupo C=O de un aminoácido y el grupo N-H de otro se denomina enlace peptídico. Este enlace es un enlace covalente más corto que la mayor parte de los enlaces C-N, posee cierto carácter de doble enlace por lo tanto no puede girar libremente, los 4 átomos implicados en el enlace junto con los 2 átomos de C a los que se unen se encuentran en un plano, y finalmente, los únicos enlaces implicados en la formación del enlace que pueden girar de forma parcialmente libre son los formados entre C-C y N-C.
c) Dos ejemplos de péptidos son la oxitocina, que regula las contracciones del útero, y la insulina, que regula la concentración de glucosa en sangre disminuyendo la cantidad de esta que hay.
ACTIVIDAD 2
En la estructura secundaria α-hélice, son enlaces de hidrógeno intracatenarios los que le dan estabilidad, en la lámina plegada β, son enlaces de hidrógeno intercatenarios, y en hélice de colágeno, son enlaces covalentes y enlaces de hidrógeno. En la estructura terciaria intervienen enlaces de hidrógeno entre grupos peptídicos, atracciones electrostáticas entre grupos con carga opuesta, atracciones hidrofóbicas, fuerzas de Van der Waals y finalmente puentes disulfuro entre grupos tiol.
ACTIVIDAD 3
El hecho de que tenga carácter anfótero quiere decir que tiene la capacidad de actuar como ácido o como base, captando o cediendo protones, en función del medio en el que se encuentren. Gracias a esto pueden regular el pH del medio.
ACTIVIDAD 4
a) La estructura terciaria de una proteína es la disposición que adoptan el el espacio la estructura secundaria cuando se pliega sobre sí misma y origina una conformación globular. esta estructura se mantiene estable gracias a las uniones entre los radicales de aminoácidos que pueden ser enlaces de hidrógeno entre grupos peptídicos, atracciones electrostáticas entre grupos con carga opuesta, atracciones hidrofóbicas, fuerzas de Van der Waals, o puentes disulfuro entre grupos tiol.
Por encima de esta estructura terciaria existe una estructura cuaternaria, que es la que se presenta cuando dos o más cadenas polipeptídicas con estructura terciaria, ya sea idénticas o no, se unen entre sí por enlaces débiles no covalentes, o a veces por enlaces covalente es de tipo disulfuro. Estas cadenas polipeptídicas reciben el nombre de protómero.
b) Al elevar la temperatura aumenta la energía cinética de las moléculas, con lo que se desorganiza la envoltura acuosa de las proteínas y se desnaturalizan. Esto significa que pierden las estructuras secundaria (a veces), terciaria y cuaternaria (si se presenta), y por lo tanto pierden su actividad biológica y cesan de ejercitar su función.


Fuente de las imágenes: propias y pixabay